
ইলেকট্রোফাইল শব্দটির উৎপত্তি হয়েছে ইলেকট্রনের প্রতি আকর্ষণ বা ইলেকট্রোফিলিসিটি থেকে। এটি এমন একটি অণু বা কার্যকরী মূলক, যেটি ইলেকট্রন গ্রহণে আগ্রহী। সাধারণভাবে ইলেকট্রোফাইল হলো ইলেকট্রন গ্রহীতা। এদের বৈশিষ্ট্য হলো—ইলেকট্রনের ঘনত্ব কম থাকে, যার ফলে তারা নতুন বন্ধন তৈরির জন্য ইলেকট্রন টানতে চায়। জৈব যৌগে অনেক সময় কার্বন পরমাণুই ইলেকট্রোফাইল হিসেবে কাজ করে, যদি সেই কার্বনে ইলেকট্রনের ঘনত্ব কম থাকে।
এর বিপরীত হলো নিউক্লিওফাইল, যা ইলেকট্রন দাতা। নিউক্লিওফাইলে সাধারণত লোন পেয়ার ইলেকট্রন বা ঋণাত্মক আধান থাকে, যা অন্য একটি ইলেকট্রোফাইলে প্রদান করে বিক্রিয়া ঘটাতে সক্ষম। অ্যালকোহল, অ্যামিন, থায়োল—এসব যৌগ নিউক্লিওফাইল হিসেবে কাজ করে, কারণ এদের অক্সিজেন, নাইট্রোজেন, সালফার পরমাণুতে লোন পেয়ার থাকে।
ইলেকট্রোফাইল এবং নিউক্লিওফাইল শনাক্ত করা জৈব বিক্রিয়ার ক্রিয়াকৌশল বোঝার জন্য অত্যন্ত জরুরি। নিউক্লিওফাইল থেকে ইলেকট্রোফাইলের দিকে তিরচিহ্ন দিয়ে ইলেকট্রনের প্রবাহ দেখানো হয়, যাকে বলা হয় ‘পুশ-পুল মেকানিজম’। এই চিহ্নগুলোই বিক্রিয়ার পথে ইলেকট্রনের চলাচল ব্যাখ্যা করে। একটি শক্তিশালী ইলেকট্রোফাইল হতে হলে শুধুমাত্র তড়িৎঋণাত্মকতা নয়, অণুর জ্যামিতিক গঠন, বন্ধনের ধরন ও দৈর্ঘ্য, বন্ধন ভাঙার স্থিতিশীলতা এবং লিভিং গ্রুপ অ্যাবিলিটি প্রভৃতি বিষয়ের ওপর নির্ভর করে।
যেমন: অ্যালকাইল হ্যালাইড ইলেকট্রোফাইল হয় কারণ কার্বন-হ্যালোজেন বন্ধনের ফলে কার্বন পরমাণুতে ইলেকট্রনের ঘনত্ব কমে যায়। এখানে
I > Br > Cl > F
এই ক্রমে ইলেকট্রোফাইলিক শক্তি বাড়ে না বরং কমে, কারণ C—I বন্ধন দুর্বল হওয়ায় ভেঙে যাওয়া সহজ হয়। একটি ভালো লিভিং গ্রুপ হওয়ার জন্য তার বিচ্ছিন্ন হয়ে স্থিতিশীল থাকতে পারা জরুরি।
যেমন, আয়োডিন (I⁻) হলো একটি দুর্দান্ত লিভিং গ্রুপ কারণ এটি বিচ্ছিন্ন হয়ে খুবই স্থিতিশীল অবস্থায় থাকে। এর যুক্তি বোঝাতে কনজুগেট অ্যাসিড-বেজ তত্ত্ব ব্যবহার করা হয়। যেহেতু হাইড্রোয়োডিক অ্যাসিড (HI) খুব শক্তিশালী, তাই তার কনজুগেট বেজ (I⁻) অনেক স্থিতিশীল। কার্বনিল যৌগগুলো খুব গুরুত্বপূর্ণ ইলেকট্রোফাইল।
অ্যালডিহাইড এবং কিটোনে যে C=O বন্ধন থাকে, সেখানে কার্বন-অক্সিজেনের তড়িৎঋণাত্মকতার পার্থক্যের ফলে কার্বনে ইলেকট্রনের ঘনত্ব কম থাকে। তবে অ্যালডিহাইড, কিটোনের তুলনায় শক্তিশালী ইলেকট্রোফাইল, কারণ কিটোনে অতিরিক্ত অ্যালকাইল গ্রুপ থাকার ফলে স্টেরিক প্রতিবন্ধকতা বেশি হয় এবং ইলেকট্রন ধাক্কাও বেশি হয়।
অ্যারোমেটিক যৌগে ইলেকট্রোফিলিসিটি নির্ভর করে বেনজিন রিংয়ের পাই ইলেকট্রনের সঙ্গে কার্বনিলের পাই ইলেকট্রনের কনজুগেশনের ওপর। বেনজালডিহাইডের ক্ষেত্রে এই কনজুগেশন থাকায় তার ইলেকট্রোফিলিক কার্বনটি তুলনামূলক কম সক্রিয়। আবার অ্যাসিটোফেনোন কিটোন হওয়ায় ও বেনজিন রিং থাকার ফলে এটি আরও দুর্বল ইলেকট্রোফাইল।
অ্যারোমেটিক কার্বনিল যৌগে যুক্ত গ্রুপগুলো ইলেকট্রোফিলিসিটিতে প্রভাব ফেলে। ইলেকট্রন উত্তোলনকারী গ্রুপ (EWG) যেমন নাইট্রাইল (–CN) থাকলে ইলেকট্রোফাইল আরও শক্তিশালী হয়, কারণ তারা কার্বনিল কার্বন থেকে ইলেকট্রন আরও টেনে নেয়। অন্যদিকে, ইলেকট্রন দাতা গ্রুপ (EDG) যেমন মিথক্সি (–OCH₃) থাকলে ইলেকট্রোফাইল দুর্বল হয়ে পড়ে, কারণ তারা ইলেকট্রন ঘনত্ব বাড়িয়ে দেয়।
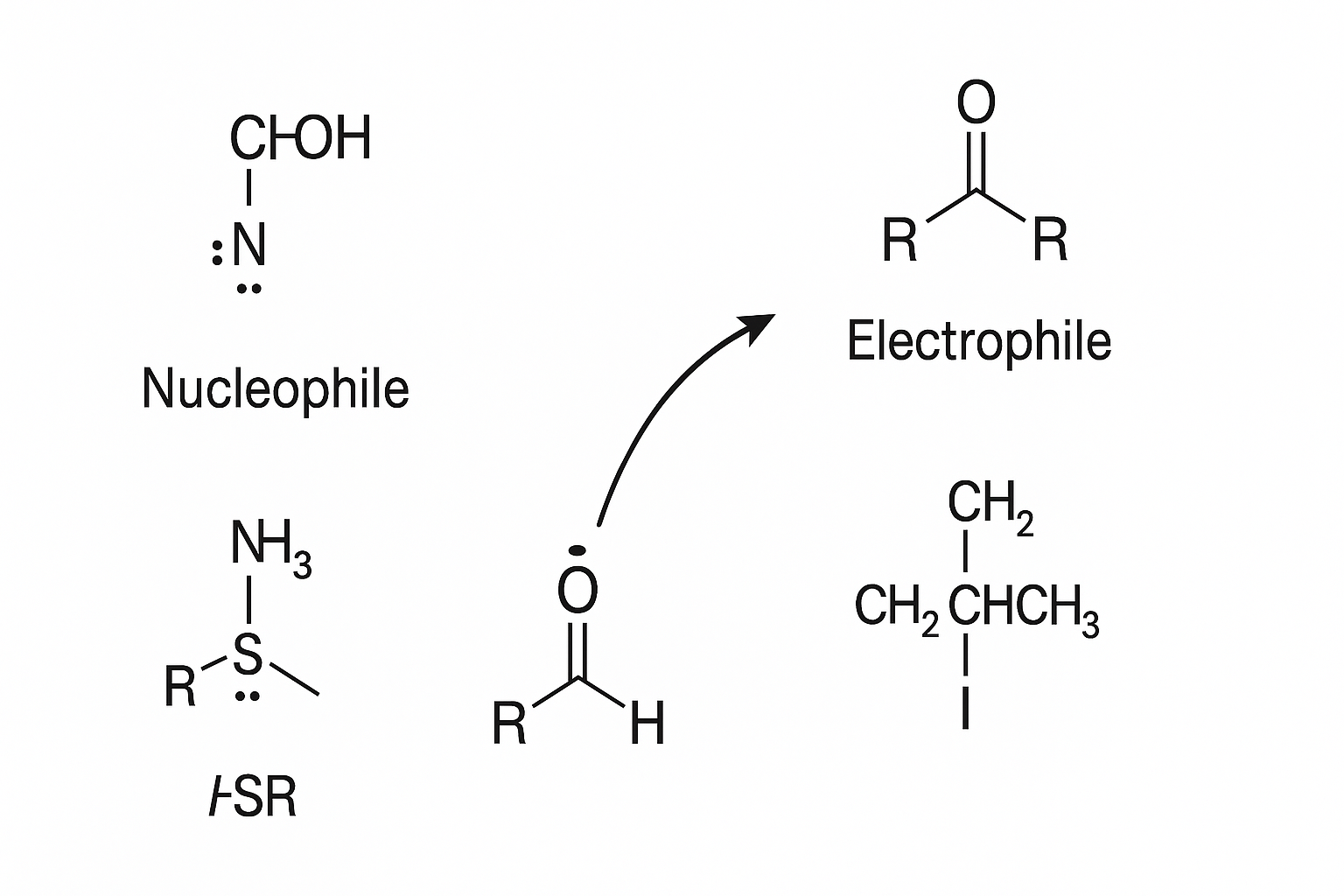
ইলেকট্রোফাইল ও নিউক্লিওফাইলের এই সমন্বয় জৈব বিক্রিয়ার প্রাণ। কোন অণু কিভাবে প্রতিক্রিয়া করবে তা নির্ভর করে এদের মধ্যে ইলেকট্রনের চলাচলের গতিপথ ও প্রস্তুতির ওপর। বোঝাপড়া যত গভীর হবে, বিক্রিয়ার গতি ও ফলাফল তত সহজে ব্যাখ্যা করা যাবে।
অ্যারোমেটিক রিংয়ে পাই ইলেকট্রন আছে। ৬টি পাই ইলেকট্রন কনজুগেটেড অবস্থায় থাকে। কার্বনিল মূলকের পাই বন্ধনও দুটি পাই ইলেকট্রনের কারণেই হয়। বেনজিন রিংয়ের পাই ইলেকট্রন এবং কার্বনিল মূলকের পাই ইলেকট্রন কনজুগেটেড অবস্থায় থাকে। স্থিতিশীল কনজুগেশন তৈরি করে। ফলে অ্যারোমেটিক অ্যালডিহাইডের কার্বনিল মূলকের কার্বনে ইলেকট্রনের ঘনত্ব, অ্যালিফেটিক যৌগের কার্বনের তুলনায় বেশি থাকে। এ কথাটা সহজে বোঝানোর জন্য এভাবে বলেছি। বস্তুত মলিকিউলার অরবিটাল থিওরির আলোকে ভিন্নভাবে ব্যাখ্যা করা যায়। কিন্তু মলিকিউলার অরবিটাল থিউরি উচ্চতর পর্যায়ের জন্য।

